1、概念及反应本质
把化学能转化为电能的装置,其本质是发生了氧化还原反应。
2、构成条件
(1)有两个活动性不同的电极(常见为金属或石墨)。
(2)将电极插入电解质溶液中。
(3)两电极间构成闭合回路(两电极接触或用导线连接)。
(4)能自发发生氧化还原反应。
3、工作原理
如图是Cu--Zn原电池
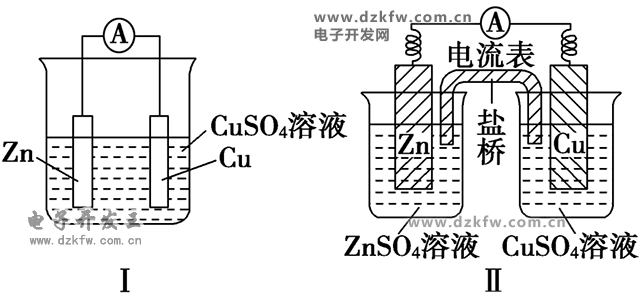
(1)反应原理
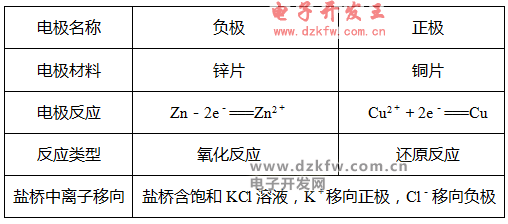
(2)原电池中的三个方向
①电子方向:从负极流出沿导线流入正极;
②电流方向:从正极沿导线流向负极;
③离子的迁移方向:电解质溶液中,阴离子向负极迁移,阳离子向正极迁移。
(3)两种装置的比较
图Ⅰ中Zn在CuSO4溶液中直接接触Cu2+,会有一部分Zn与Cu2+直接反应,该装置中既有化学能和电能的转化,又有一部分化学能转化成了热能,装置的温度会升高。
图Ⅱ中Zn和CuSO4溶液分别在两个池中,Zn与Cu2+不直接接触,不存在Zn与Cu2+直接反应的过程,所以仅是化学能转化成了电能,电流稳定,且持续时间长。
(4)盐桥作用
①连接内电路,形成闭合回路;
②平衡电荷,使原电池不断产生电流。
归纳总结
1、原电池的工作原理简图

注意:
①一般负极金属较活泼,正极金属或非金属不活泼。
②一般负极溶解或质量减轻,正极有气泡或质量增重。
③若有盐桥,盐桥中的阴离子移向负极区,阳离子移向正极区。
2、原电池的判断方法
(1)先分析有无外接电源,有外接电源的为电解池,无外接电源的可能为原电池。
(2)然后依据原电池的形成条件判断装置是否为原电池,方法如下:

(3)多池相连,但无外接电源时,两极活泼性差异最大的一池为原电池,其他各池可看做电解池。
3、原电池正、负极判断的七种方法
(1)由组成原电池的两极材料判断。
一般相对较活泼的金属为负极,相对不活泼的金属或能导电的非金属为正极。
(但也有一些并不与活泼性一致,如Mg、Al在酸性介质中,Mg作负极,而在碱性介质中,Al作负极)
(2)根据电流方向或电子流动方向判断。
在外电路,电流由正极流向负极;电子由负极流向正极。
(3)根据原电池里电解质溶液中离子的定向移动方向判断。
在原电池的电解质溶液内,阳离子移向正极,阴离子移向负极。
(4)根据原电池两极发生的变化来判断。
原电池的负极发生氧化反应,正极发生还原反应。
(5)X极增重或减轻。
工作后,X极质量增加,说明X极有物质析出,X极为正极;反之,X极质量减少,说明X极金属溶解,X极为负极。
(6)X极有气体产生。
工作后,X极上有气体产生,一般若发生了析出H2的电极反应,说明X极为正极。
(7)根据X极附近pH的变化来判断。
析氢或吸氧的电极反应发生后,均能使该电极附近电解质溶液的pH增大,因而工作后,X极附近pH增大了,说明X极为正极。







 返回顶部
返回顶部 刷新页面
刷新页面 下到页底
下到页底