金属防锈剂背后的电池反应秘密
大家好,今天我们来聊聊金属防锈剂和电池反应之间的有趣关系。金属防锈剂的存在其实是因为自然界中的电池反应,这听起来有点神奇吧?让我来给你们详细解释一下。
原电池的构成条件
1.活泼性不同的两个电极。
2.电解质溶液,一般能与较活泼金属自发地进行氧化还原反应。
3.形成闭合回路。
1、概念及反应本质
把化学能转化为电能的装置,其本质是发生了氧化还原反应。
2、构成条件
(1)有两个活动性不同的电极(常见为金属或石墨)。
(2)将电极插入电解质溶液中。
(3)两电极间构成闭合回路(两电极接触或用导线连接)。
(4)能自发发生氧化还原反应。
归纳总结
1、原电池的工作原理简图

注意:
①一般负极金属较活泼,正极金属或非金属不活泼。
②一般负极溶解或质量减轻,正极有气泡或质量增重。
③若有盐桥,盐桥中的阴离子移向负极区,阳离子移向正极区。
铁生锈的化学原理 🌿
在中学时代,我们学过铁生锈的化学方程式:铁 + 氧气 = 四氧化三铁(或三氧化二铁)。这个反应其实是因为铁的活性较大,容易和氧气发生化学反应,生成铁锈。虽然这个解释很简单,但它确实说明了铁在空气中会生锈。
电池反应的复杂性 🔋
到了高中,我们接触到了电化学反应,也就是电池反应。这时候老师会告诉我们,铁在空气中并不是直接和氧气反应,而是和水一起参与了一个复杂的电池反应。简单来说,我们把铁作为原电池的负极,铁表面的氧气作为正极,在水作为电解质的情况下,铁很快失去电子,形成亚铁和铁离子,而正极氧气得到电子成为负二价,并与铁形成氧化铁。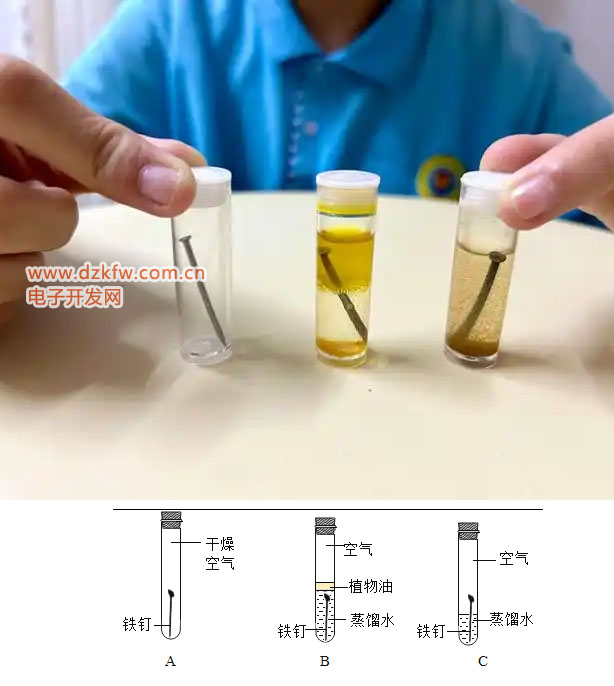
水的角色 💧
这个反应中,水的参与是关键。因为在电解质中需要阴离子的存在,负二价的阳离子是无法在电解质中存在的,通常是快速与水合并形成负一价的氢氧根离子,先与铁形成氢氧化铁。而氢氧化铁会进一步与水和氧气发生反应生成氧化铁。如果产生氢氧化亚铁,将继续电池反应,直到稳定为三氧化二铁。
电子的流向
虽然这个反应非常复杂,说不清楚正极和负极到底在哪里,也说不清楚电子的流向,但这个过程随时会发生,天天在运行。要不是这样,铁不会轻易生锈,也用不着金属除锈剂。
防锈剂的必要性
氧化还原反应就是这样,不需要外界提供热量,反而会放出热量。从电化学的角度来说,是电动势大于0,呆不住。总之,铁、水、氧气放在一起就是不老实,不放点热量出来,稳定不了,铁锈就这样轻易地产生了。
结语 🌟
因此,再评价铁的原电池的电池反应就是个无解的问题。似乎也不存在没有空气和水蒸气的环境来使用金属,即使存在也只是相对的。含氧气和水分的多与少。引用一个朋友的话说,世界上还真是不存在任何一种物质,放在那里不管它,不会往坏掉或者不好的方向发展,只有人类就是不断的开发一些“逆商”的产物,铁会生锈,就开发金属除锈剂和防锈剂之类的产品来解决它。
以上就是今天的分享,希望对大家有所帮助!


 返回顶部
返回顶部 刷新页面
刷新页面 下到页底
下到页底