铜的电解精炼
原理:电解时,用粗铜板作阳极,与直流电源的正极相连;用纯铜板作阴极,与电源的负极相连,用CuSO4溶液(加入一定量的硫酸)作电解液。
CuSO4溶液中主要有Cu2+、SO42-、H+、OH-,通电后H+和Cu2+移向阴极,并在阴极发生Cu2++2e-=Cu,OH-和SO42-移向阳极,但阳极因为是活性电极,故而阴离子并不放电,主要为阳极(活泼及较活泼金属)发生氧化反应而溶解,阳极反应:Cu-2e-=Cu2+。
电解过程中,比铜活泼的Zn、Fe、Ni等金属杂质,在铜溶解的同时也会失电子形成金属阳离子而溶解,此时阴极仍发生Cu2++2e-=Cu,这会导致电解液浓度不发生变化;Ag、Au不如Cu易失电子,Cu溶解时它们以阳极泥沉积下来,可供提炼Au、Ag等贵金属。
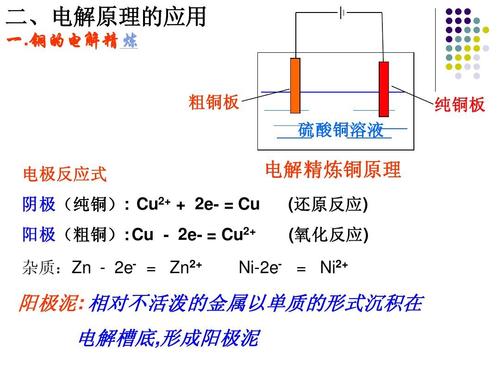
该过程实现了提纯铜的目的。
离子在电极上得失电子的能力与离子的性质、溶液的浓度、电流的大小、电极的材料等都有关系。中学阶段我们一般只讨论电极材料的性质、离子的氧化性强弱和还原性强弱对它们得失电子能力的影响。
三
电解冶炼铝
工业上,用纯净的氧化铝为原料,采用电解的方法制取铝。
纯净的氧化铝熔点很高(2045℃),很难熔化,现在都用熔化的冰晶石(Na3AlF6)作熔剂,使氧化铝在1000℃左右溶解在液态的冰晶石里,成为冰晶石和氧化铝的熔融体,然后进行电解。
电极反应式:
阴极:4Al3++12e-=4Al
阳极:6O2-+12e-=3O2↑
总反应式:2Al2O3==4Al+3O2↑(只能电解Al2O3,不能电解AlCl3)
在冶炼铝时,阳极产生氧气,石墨阳极在如此高温条件下,将不断被氧气氧化而消耗,因而需不断补充石墨阳极。
四
电镀铜
1.原理:电镀时,一般都是用含镀层金属离子的电解质溶液为电镀液;把待镀金属制成品浸入电镀液中与直流电源的负极相连,作为阴极,而用镀层金属为阳极,阳极金属溶解在溶液中成为阳离子,移向阴极,并在阴极上被还原成金属析出。
电镀铜规律可概括为“阳极溶解,阴极沉积,电解液不变”。
工业上电镀常使用有毒电镀液,因此电镀废水应回收有用物质、降低有害物质含量后,达标排放,以防污染环境。
2.实验分析:电镀铜实验
(1)待镀件需酸洗去除表面的锈。
(2)电镀液CuSO4中加氨水制成铜氨溶液以降低Cu2+浓度使镀层光亮。
电镀:
概念:应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法。
目的:使金属增强抗腐蚀能力,增加美观和表面硬度。镀件(待镀金属制品)作阴极
如在铁制品表面上镀铜:
注意:理论上,电镀过程中电镀液的浓度保持不变。
电冶金:
电解法:用电解的手段将活泼金属(如Na、Ca、 Mg、Al)从它们的化合物中还原出来的方法。
实例
电解熔融NaCl制Na
电解熔融Al2O3制Al
化学电解四大类型
电解饱和食盐水反应原理
实验分析:电解饱和食盐水
在U形管里装入饱和食盐水,滴入几滴酚酞试液,用碳棒作阳极、铁棒作阴极,将湿润的碘化钾淀粉试纸放在阳极附近,接通电源,观察管内发生的现象及试纸颜色的变化。
注意:铁棒不可作阳极,否则发生Fe - 2e- = Fe2+;碘化钾淀粉试纸需事先用水润湿。
现象:阴、阳两极均有气体放出,阳极气体有刺激性气味,能使湿润的碘化钾淀粉试纸变蓝;阴极区域溶液变红。说明阴极区域生成物为碱性物质与H2,阳极产物是Cl2。
电解饱和食盐水反应原理
饱和食盐水成分:溶液存在Na+、Cl-、H+、OH-四种离子。
电极反应式:
阴极:2H++2e- = H2↑(还原反应);
阳极:2Cl--2e- = Cl2↑(氧化反应);
实验现象解释:
阴极区域变红原因:由于H+被消耗,使得阴极区域OH-离子浓度增大(实际上是破坏了附近水的电离平衡,由于Kw为定值,c(H+)因电极反应而降低,导致c(OH-)增大,使酚酞试液变红)。
湿润的碘化钾淀粉试纸变蓝原因:氯气可以置换出碘化钾中的碘,Cl2+2KI=2KCl+I2,I2使淀粉变蓝。
注意:如果试纸被熏蒸的太久,蓝色会因为湿氯气的漂白作用而褪去。
电解饱和食盐水的总反应式:
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
该电解反应属于放氢生碱型,电解质与水均参与电解反应,类似的还有K2S、MgBr2等。


 返回顶部
返回顶部 刷新页面
刷新页面 下到页底
下到页底