分子间作用力的本质是什么?分子间作用力的本质是物质之间的电磁相互作用。
在物质中,分子是由带有正电荷和负电荷的原子组成的。这些电荷在分子中形成电场,导致分子之间发生相互作用。
分子间作用力包括范德华力、氢键、离子键等,它们都源于分子中的电荷分布和电子云的极化效应。
范德华力是由于分子中电子云的瞬时偶极矩导致的瞬时吸引力,氢键是由于分子中氢原子和带有电负性的原子之间的电荷相互作用导致的吸引力,离子键则是由于带正电荷的离子和带负电荷的离子之间的电荷相互作用而产生的强力。
总之,分子间作用力的本质是物质中带有电荷的分子之间相互作用的结果,这种相互作用可以解释物质的很多性质和现象,例如物质的相态转变、分子的凝聚、分子的反应等。
分子间作用力
一.分子间偶极矩
二 分子间作用力——范德华力
化学键的结合能一般在 1.0×102kJ/mol 数量级, 而分子间力的能量只有几个 kJ/mol.
1.取向力
极性分子之间靠永久偶极-永久偶极作用称为取向力.仅存在于极性分子之间.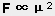
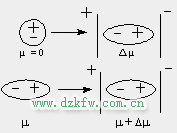
2. 诱导力
诱导偶极与永久偶极作用称为诱导力.
极性分子作用为电场, 使非极性分子产生诱导偶极或使极性分子的偶极增大(也产生诱导偶极), 这时诱导偶极与永久偶极之间形成诱导力, 因此诱导力存在于极性分子与非极性分子之间, 也存在于极性分子与极性分子之间.
3、色散力
瞬间偶极-瞬间偶极之间有色散力.
由于各种分子均有瞬间偶极, 故色散力存在于极性分子-极性分子、极性分子-非极性分子及非极性分子-非极性分子之间. 色散力不仅存在广泛, 而且在分子间力中, 色散力经常是重要的. 观察下面数据:
kJ/mol 取向力 诱导力 色散力
Ar 0 0 8.49
HCl 3.305 1.104 16.82
取向力、诱导力和色散力统称范德华力, 它具有以下的共性:
1) 永远存在于分子之间;
2) 力的作用很小;
3) 无方向性和饱和性;
4) 是近程力,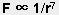
5) 经常是色散力为主.
He Ne Ar Kr Xe
从左到右原子半径(分子半径)依次增大, 变形性增大, 色散力增强, 分子间结合力增大, 故 b.p. 依次增高. 可见, 范德华力的大小与物质的 m.p.、b.p. 等物理性质有密切联系.
1.取向力
极性分子之间靠永久偶极-永久偶极作用称为取向力.仅存在于极性分子之间.
2. 诱导力
诱导偶极与永久偶极作用称为诱导力.
极性分子作用为电场, 使非极性分子产生诱导偶极或使极性分子的偶极增大(也产生诱导偶极), 这时诱导偶极与永久偶极之间形成诱导力, 因此诱导力存在于极性分子与非极性分子之间, 也存在于极性分子与极性分子之间.
3、色散力
瞬间偶极-瞬间偶极之间有色散力.
由于各种分子均有瞬间偶极, 故色散力存在于极性分子-极性分子、极性分子-非极性分子及非极性分子-非极性分子之间. 色散力不仅存在广泛, 而且在分子间力中, 色散力经常是重要的. 观察下面数据:
kJ/mol 取向力 诱导力 色散力
Ar 0 0 8.49
HCl 3.305 1.104 16.82
取向力、诱导力和色散力统称范德华力, 它具有以下的共性:
1) 永远存在于分子之间;
2) 力的作用很小;
3) 无方向性和饱和性;
4) 是近程力,
5) 经常是色散力为主.
He Ne Ar Kr Xe
从左到右原子半径(分子半径)依次增大, 变形性增大, 色散力增强, 分子间结合力增大, 故 b.p. 依次增高. 可见, 范德华力的大小与物质的 m.p.、b.p. 等物理性质有密切联系.
三 氢键
1. 氢键的概念
以 HF 为例, F 的电负性相当大, 电子对偏向 F, 而 H 几乎成了质子, 这种 H 与其它分子中电负性相当大、r 小的原子相互接近时, 产生一种特殊的分子间力 —— 氢键. 表示为···· : F-H····F-H
两个条件: 1.与电负性大且 r 小的原子(F, O, N)相连的 H ; 2. 在附近有电负性大, r 小的原子(F, O, N).
2. 氢键的特点
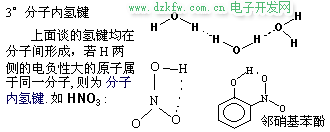
1°饱和性和方向性
由于 H 的体积小, 1 个 H 只能形成一个氢键.由于 H 的两侧电负性极大的原子的负电排斥, 使两个原子在 H 两侧呈直线排列. 除非其它外力有较大影响时, 才可能改变方向.
2°氢键的强度
介于化学键和分子间作用力之间, 和电负性有关.
F-H ···· F O — H ···· O N-H····N
E/kJ·mol-1 28.0 18.8 5.4
3. 氢键对于化合物性质的影响
分子间存在氢键时, 大大地影响了分子间的结合力, 故物质的熔点、沸点将升高. CH3CH2-OH 存在分子间氢键,而分子量相同的 H3C-O-CH3 无氢键,故前者的 b.p. 高。
HF、HCl、HBr、HI , 从范德华力考虑, 半径依次增大, 色散力增加, b.p. 高, 故 b. P. 为 HI > HBr > HCl, 但由于 HF 分子间有氢键,故 HF 的b.p. 在这里最高, 破坏了从左到右 b.p. 升高的规律. H2O, NH3 由于氢键的存在, 在同族氢化物中 b.p. 亦是最高.
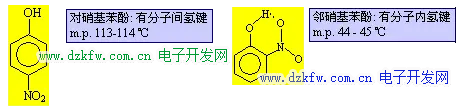
H2O 和 HF 的分子间氢键很强, 以致于分子发生缔合, 以(H2O)2、 (H2O)3、(HF)2、(HF)3 形式存在, 而 (H2O)2 排列最紧密, 4℃时, (H2O)2 比例最大, 故 4℃ 时水的密度最大. 可以形成分子内氢键时, 势必削弱分子间氢键的形成. 故有分子内氢键的化合物的沸点、熔点不是很高.典型的例子是对硝基苯酚和邻硝基苯酚:
以 HF 为例, F 的电负性相当大, 电子对偏向 F, 而 H 几乎成了质子, 这种 H 与其它分子中电负性相当大、r 小的原子相互接近时, 产生一种特殊的分子间力 —— 氢键. 表示为···· : F-H····F-H
两个条件: 1.与电负性大且 r 小的原子(F, O, N)相连的 H ; 2. 在附近有电负性大, r 小的原子(F, O, N).
2. 氢键的特点
1°饱和性和方向性
由于 H 的体积小, 1 个 H 只能形成一个氢键.由于 H 的两侧电负性极大的原子的负电排斥, 使两个原子在 H 两侧呈直线排列. 除非其它外力有较大影响时, 才可能改变方向.
2°氢键的强度
介于化学键和分子间作用力之间, 和电负性有关.
F-H ···· F O — H ···· O N-H····N
E/kJ·mol-1 28.0 18.8 5.4

3. 氢键对于化合物性质的影响
分子间存在氢键时, 大大地影响了分子间的结合力, 故物质的熔点、沸点将升高. CH3CH2-OH 存在分子间氢键,而分子量相同的 H3C-O-CH3 无氢键,故前者的 b.p. 高。
HF、HCl、HBr、HI , 从范德华力考虑, 半径依次增大, 色散力增加, b.p. 高, 故 b. P. 为 HI > HBr > HCl, 但由于 HF 分子间有氢键,故 HF 的b.p. 在这里最高, 破坏了从左到右 b.p. 升高的规律. H2O, NH3 由于氢键的存在, 在同族氢化物中 b.p. 亦是最高.
H2O 和 HF 的分子间氢键很强, 以致于分子发生缔合, 以(H2O)2、 (H2O)3、(HF)2、(HF)3 形式存在, 而 (H2O)2 排列最紧密, 4℃时, (H2O)2 比例最大, 故 4℃ 时水的密度最大. 可以形成分子内氢键时, 势必削弱分子间氢键的形成. 故有分子内氢键的化合物的沸点、熔点不是很高.典型的例子是对硝基苯酚和邻硝基苯酚:





 返回顶部
返回顶部 刷新页面
刷新页面 下到页底
下到页底